알츠하이머 신약 '아두카누맙' FDA 승인
자문위원 반발...사임 이어져
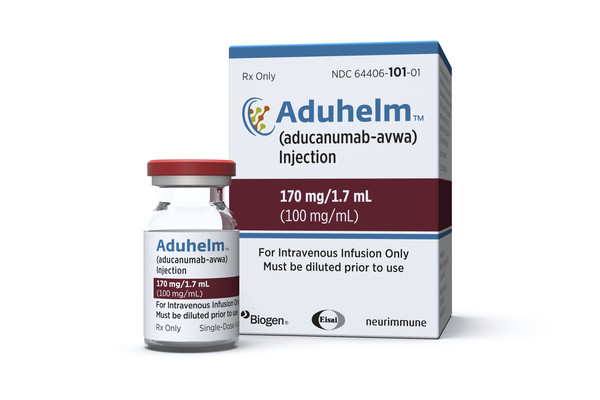
[월드투데이=경민경 기자] 지난 7일(현지시간) 미국 식품의약안정청(FDA)은 18년 만에 알츠하이머 신약을 승인했다. 그러나 '아두카누맙'(Aducanumab)이라고 명명되는 이 약에 대한 논란이 이어지면서 이번 조처에 반발하는 FDA 자문위원들이 잇따라 사임하고 있다.
10일(현지시간) 워싱턴포스트(WP)와 CNN에 따르면 FDA의 외부 전문가 자문그룹 자문위 소속인 신경과 전문의 데이비드 노프먼이 이번 조처에 반발해 사임했다. 또 다른 자문위원인 조엘 펄머터 박사도 사임 의사를 밝혔다는 의료전문지 STAT뉴스의 보도도 나왔다.
신약 승인에 앞서 많은 전문가들은 이 약의 효능에 대해 의문을 제기했다. 특히 FDA의 외부 전문가 그룹인 PCNN 자문위는 지난해 11월 신약을 승인할 충분한 증거가 없다고 판단해 승인을 권고하지 않기로 결론 내린 바 있다.
그러나 FDA는 미국 제약사 바이오젠의 데이터를 토대로 승인했다. 이에 이번에 사임한 노프먼은 "아두카누맙과 관련해 외부 전문가들이 존중받지 못한 그런 대우를 받고 싶지 않아 사임했다"며 "신약 승인 결정에 동의하지 않는다"고 이번 FDA 조처에 강력한 반대 입장을 내비쳤다.

◇ 효능 논란 '아두카누맙'(Aducanumab), 승인 과정도 의문
FDA는 치매 환자의 인지 능력 감소 속도를 늦추는 결과가 입증됐다는 바이오젠의 데이터를 토대로 이번 신약의 판매를 승인했다.
'아두카누맙'으로 명명됐던 이 약은 알츠아이머의 원인이 되는 뇌의 '베타-아밀로이드'를 제거하는 것을 목표로 한다.
당초 바이오젠은 이 약의 임상시험 두 건을 진행하다 약효가 보이지 않아 2019년 시험을 중단한 바 있다. 그러나 불과 몇 달 뒤 임상과 관련한 추가 데이터를 검토한 결과 약효과를 확인됐다며 입장을 바꾸었다.
바이오젠은 두 건 중 한 건에서 이 약을 투여한 환자의 사고 능력 저하가 대조군보다 22% 덜했다고 설명했다.
전문가들은 바이오젠의 데이터만으로는 약효가 확실하게 입증되지 않는다며 비판했다. 지난해 11월 FDA의 외부 전문가 자문위는 약의 유효성을 입증할 데이터가 부족하다며 FDA에 승인을 권고하지 않기로 한 바 있다.
그러나 FDA는 바이오젠의 데이터를 토대로 신약을 '조건부' 승인했다. 다만 논란을 의식한 듯 바이오젠에 약의 효능을 확인하기 위한 후속 연구를 진행하라는 요건을 부과했다.
이번 승인은 2008년~2015년 FDA의 신약 승인 결정의 89%가 자문위의 결정을 따른 것과는 대비된다. 이에 따라 전문가들은 승인 과정에도 의문을 제기했다.
◇ '비싼 가격' 논란까지...1인 연간 5만6천달러(6300만원)
아두카누맙의 비싼 가격도 논란을 부추기고 있다.
바이오젠은 아두카누맙의 1년 약값을 1인당 5만6천달러(6200만원)로 책정했다.
이번 신약 투여 대상자는 뇌에 아밀로이드가 쌓인 초기 단계 환자에 국한되는데, 보험회사 시그나는 미국 내 알츠하이머병 환자 약 600만명 중 이 기준에 충족하는 사람은 140만명 정도인 것으로 추정했다.
모든 알츠하이머병 환자가 약을 접하지 못할 것으로 전망되는 가운데, 약값 또한 비싸게 책정돼 논란이 되고 있다.
앞서 전문가들은 약 값을 연간 1만~2만5천달러(약 1000만~2700만)로 예상했다. 그러나 바이오젠은 이를 두 배 이상 뛰어넘는 가격을 내놓은 것이다.
미국 알츠하이머병 환자 대부분이 메디케어(65세 이상 노인 공공 건강보험)에 가입했는데, 공공보험만으로는 가입자 부담이 상당할 것으로 예상된다. 또한 약 값뿐만 아니라 치료비와 관련 검사비까지 더해지면 가입자들은 연간 1만달러(약1천100만원)을 부담해야 할 수도 있다.
AP통신은 "환자나 가족들은 새로운 치료법이 작은 효능이라도 있다고 판단되면 승인해야 한다고 요구하는 반면 전문가들은 효과가 의심스러운 치료법을 승인하는 것은 위험한 선례를 남길 수 있다며 경계해왔다"고 전했다.
신약의 조건부 승인을 받은 바이오젠과 에자이는 추가 임상시험을 통해 약의 효능을 입증해야 한다.
--